
ИСПОЛЬЗОВАНИЕ СПИРТА В АКАРИУМЕ.
Практическая
часть (Продолжение).
Перейти к теоретической
части.
Для подтверждения основных теоретических выводов
было проведено два опыта. Один в банке с аэрацией, второй в герметично
закрытой банке без доступа воздуха.
Опыт №1 (в аэробных условиях).
Контрольный аквариум: 40 литров, давно запущенный
с редкими подменами воды, аэрация, без фильтра, грунт не сифонится. Население
- пара анциструсов, ампулярии. Немного растений. Нитраты – 30 мг/л.
Тест на нитраты – НИЛПа. Контроль на осмотической
воде: нитраты – 0.
Экспериментальная банка: 3 литра, вода из
контрольного аквариума, постоянная аэрация. Температура 26-30 град. Население
- одна ампулярия. Добавлено: немного ила из контрольного аквариума, 5 мл 0,1%
раствора Кемиры-Люкс, 1 мл водки. Нитраты >40.
3 часа: нитраты – 40. Добавлен 1 мл водки (были
подозрения, что спирт улетучивается при аэрации)
5 часов: нитраты – 30.
8 часов: нитраты – 20. Добавлен 1 мл водки.
11 часов: нитраты < 20.
14 часов: нитраты < 20. Контроль в основном
аквариуме: нитраты – 30. Добавлен 1 мл водки.
18 часов: нитраты – 20. Появились подозрения, что
тест не корректный. Нитриты – 20. (тот же тест, только без порошка). Судя по
тесту, в системе нет нитратов, а окраска индикатора обусловлена только
наличием нитритов. Заметно помутнела вода.
30 часов: нитраты – 0 (как после осмоса). Вода
мутная.
43 часа: Нитраты – 0. Вода мутная.
3 сутки: Нитраты – следы. Вода стала намного
прозрачней. В воде отмечается увеличение количества подвижных простейших,
резкое уменьшение числа бактерий. На улитке и стенках банки образовался белый
налет.
При микроскопии «белого мха» никакой структуры
грибов не обнаружено. Как и предполагалось – слизь представляет собой
конгломераты различных по морфологическим свойствам бактерий и большое
количество различных подвижных и неподвижных форм простейших. Показательное
фото не получится, простейшие при таком способе фиксации и окраски
разрушаются и бактерии «лежат» довольно плотно. Нативный препарат нормально
снять трудно.
Микроскопия:
Контрольный
аквариум:
нативный препарат - Несколько простейших,
небольшое количество мелких кокков.

Экспериментальная
банка:
5 часов:
· нативный препарат -
несколько больше простейших, чем в контрольной банке. Появились подвижные
формы бактерий.
12 часов:
· нативный препарат -
много бактерий, практически нет простейших.
19 часов:
· окраска – метиленовый
синий. Простейших нет. Много разных по морфологии бактерий. В основном –
кокки. Много «двойных» форм, что может быть следствием активного деления.

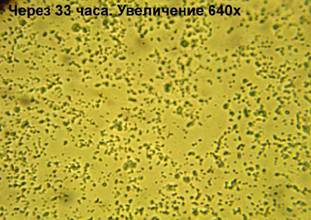
33 часа:
· окраска – метиленовый
синий - Количество бактерий увеличилось. Культура стала старше (много крупных
бактерий). Меньше двойных форм. Это может говорить о снижении темпов роста и
деления бактерий.
43 часа:
· нативный препарат -
Большое количество крупных подвижных простейших, хорошо различимых при
увеличении 48х, При увеличении 640х в их клетках различимы ядра и другие
структуры. Некоторые имеют жгутики (большая часть имеет по одному жгутику).
Количество бактерий резко уменьшилось. Редко встречаются подвижные формы
бактерий.
· окраска – метиленовый
синий - Несколько уменьшилось количество бактерий, бактерии крупные, форм в
стадии деления мало. В препарате присутствуют разрушившиеся формы простейших
(см. фото №1) На фотографии простейшие выведены из поля зрения.

Из-за сомнений по поводу появления нитритов в
экспериментальной банке проведен промежуточный опыт. Приготовлен раствор
нитрита калия, на котором тест от НИЛПа без порошка показывал 20 мг/л (я
сознательно не говорю о реальной концентрации, есть сомнения по поводу
достоверности теста). Нитрит калия получен при нагревании нитрата калия
(температура плавления – около 340 град. - начало разложения, температура
разложения 400 град.).
В этом растворе две ампулярии и четыре катушки
чувствовали себя вполне нормально и были активны.
Возможно, что в ходе опыта с аэрацией
действительно был подъем концентрации нитритов и контрольная ампулярия при
такой концентрации могла нормально существовать.
Возможные
причины появления нитритов в аквариуме при использовании спирта.
1.
Способность к нитратному дыханию показана у многих
бактерий. И этот вариант не намного менее эффективный, чем использование
атомарного кислорода. (изменение свободной энергии при окислении 1 молекулы
глюкозы молекулярным кислородом (DG0' = – 2870 кДж/моль) того же порядка, что
и окисление этого же субстрата в анаэробных условиях нитратом,
восстанавливающимся до нитрита (DG0' = — 2770 кДж/моль) или молекулярного
азота (DG0' = — 2700 кДж/моль). Механизм регуляции перехода с одного пути на другой происходит через
подавление молекулярным кислородом активности нитрогеназы, которая катализирует
фиксацию молекулярного азота. Возможно, что при наличии достаточного
количества легкодоступного питания (спирта) и высокой скорости обменных
процессов бактерий, не смотря на аэрацию и высокое содержание кислорода в
аквариуме, бактерии испытывают недостаток в молекулярном кислороде (низкая
концентрация О2 внутри бактериальной клетки, О2 проникает в клетку
посредством диффузии и скорость проникновения ограничена.). В этом случае подавление нитрогеназы менее
выражено и вместе с молекулярным кислородом используются и нитраты. Но
большинство факультативных аэробов при дыхании способны восстановить нитраты
только до нитритов, которые некоторое время накапливаются в системе, а потом
используются как источник азота для синтеза белков.
2.
Я также допускаю, что из-за такой бурной реакции
окисления спирта (4 мл спирта на 3 литра воды) аэрации не хватало и
концентрация кислорода в воде была низкой. Во второй половине опыта аэрация
была вполне умеренная - только воду перемешивала. В таких условиях часть
бактерий могла использовать азотное дыхание и восстанавливать нитраты до
нитрита. Чтобы это проверить надо повторить опыт с контролем О2 в воде.
Опыт №2 (в условно анаэробных условиях).
Контрольный аквариум прежний.
Экспериментальная банка: Подготовка воды -
нагревание до кипения (удаление растворенных газов), остывание до 30 град.
Добавлено 5 мл 0,1% раствора Кемиры-Люкс, 4 мл водки. В связи с тем, что при
кипячении большинство бактерий погибло, из контрольного аквариума добавлено большое
количество ила (примерно в 5 раз больше чем в опыте №1) и 300 мл воды. Ил
взят по возможности от самого дна, где могли находится анаэробные бактерии.
На дно банки установлен перевернутый стакан 250 мл для сбора газа (возможно,
что пойдет процесс денитрификации с выделением молекулярного азота). Банка
закрыта полиэтиленовой крышкой, которая открывается только для забора
контрольных проб воды. Воздушное пространство между уровнем воды и крышкой
незначительное (не более 2 см). Тест НИЛПа. На нитриты – без порошка, на
нитраты – согласно инструкции (значения теста нитриты/нитраты = 40/40 это то,
что показывает тест без порошка и с ним, реально получается 40/0).
Контрольный тест нитриты/нитраты – следы/40.
10 часов: нитриты/нитраты – 30/40 (разница мало
заметна). В перевернутом стакане появилось несколько пузырьков газа диаметром
не более 0,5 мм. Вода прозрачная.
16 часов: нитриты/нитраты - >40/>40.
Некоторое ощущение, что их стало даже больше. Количество газа в перевернутом
стакане не изменилось. Вода прозрачная.
30 часов: нитриты/нитраты - 40/40. Количество газа в перевернутом
стакане не изменилось. Вода слегка мутная. На поверхности выраженная
бактериальная пленка с неприятным запахом.

Микроскопия.
Контрольная микроскопия после запуска
экспериментальной банки:
· нативный препарат – в
капле присутствуют несколько взрослых форм инфузорий, небольшое количество
подвижных бактерий.
· окраска – метиленовый
синий: Небольшое количество разных по морфологии бактерий, в основном кокки.
(см фото №2). По количеству и морфологии бактерий вода в экспериментальной
банке похожа на контрольный аквариум.

10 часов:
· нативный препарат – небольшое количество подвижных бактерий. В
капле обнаружена одна инфузория.
· окраска – метиленовый
синий: Небольшое количество разных по морфологии бактерий, чуть больше
палочек, кокков поменьше (см фото №2). Большого увеличения количества
бактерий не отмечается.

30 часов:
· нативный препарат –
простейшие отсутствуют, небольшое количество подвижных бактерий.
· окраска – метиленовый
синий: Бактерии крупные, сходные по морфологическому строению. Количество
меньше, чем в опыте с аэрацией.

Выводы:
Начало
(часть 1. Теоретическая)